|



   |
|
La meilleure invention du millénaire !
Dans le supplément spécial du New York Times du 18 avril 1999, intitulé : «The Best Ideas, Stories and Inventions of the Last Thousand Years», Oliver Sacks (p. 116) a défendu l'idée que la meilleure invention du millénaire avait été le tableau périodique des éléments chimiques. Voyons si cette opinion se justifie en retraçant les grandes étapes de l'évolution du tableau périodique de Mendeleïev.
Tous les éléments chimiques connus et à venir trouvent leur place selon un système proposé par Dimitri Y. Mendeleïev (1834-1907) au siècle dernier et représenté aujourd'hui par nos tableaux périodiques modernes. Ce chimiste russe fit une étude approfondie de la relation entre les poids atomiques (la propriété fondamentale la mieux connue à cette époque) et les propriétés chimiques et physiques des éléments et découvrit l'existence d'un ordre naturel qui s'exprime, en bref, par la loi : «Les propriétés sont des fonctions périodiques des poids atomiques». En 1869, Mendeleïev illustra cette loi en publiant une première classification (tableau 1) dans laquelle il rangea les 63 éléments reconnus comme tels par ordre de poids atomiques croissants en utilisant un système de rangées et de colonnes de manière à refléter les analogies chimiques et physiques entre groupes d'éléments. En 1871, Mendeleïev améliora cette classification (tableau 2) en changeant la place de 17 éléments à la suite de la révision des poids atomiques, qui faisaient alors l'objet d'un examen très attentif. Ces modifications s'avérèrent justifiées à l'exception de 4 éléments (Di, Ce, Er, La) qui trouvèrent éventuellement leur place dans le groupe des «terres rares» : Di, le didymium, s'est avéré être un mélange de « terres rares ». En 1871, Mendeleïev présenta aussi une classification (tableau 3) qui voulait refléter le pouvoir combinatoire (la valence) des éléments avec l'hydrogène et l'oxygène : les éléments étaient disposés sur huit colonnes, numérotées I à VIII, selon la valence, et partagés en sous-groupes, selon les analogies chimiques. C'est de cette classification que découlent la division des éléments en groupes A et B et le format dit «court» du tableau périodique, qui a été longtemps en usage (tableau 4). Pour respecter les analogies entre éléments, Mendeleïev laissa de nombreuses cases vides dans les classifications de 1871 et eut l'audace de prédire que 9 d'entre elles seraient remplies par des éléments alors inconnus. Il alla jusqu'à décrire de façon détaillée les propriétés de 3 de ces inconnus et de façon plus générale celles des autres. La réalisation rapide des trois prédictions détaillées par l'identification du gallium (1875), du scandium (1879)   , et du germanium (1886) fut un triomphe pour la nouvelle classification qui, dès lors, suscita un immense intérêt dans la communauté scientifique. Quatre des six autres prédictions se réalisèrent beaucoup plus tard avec l'identification de 2 radioéléments naturels (Fr et Po), du premier radioélément artificiel (Tc) et du rhénium. , et du germanium (1886) fut un triomphe pour la nouvelle classification qui, dès lors, suscita un immense intérêt dans la communauté scientifique. Quatre des six autres prédictions se réalisèrent beaucoup plus tard avec l'identification de 2 radioéléments naturels (Fr et Po), du premier radioélément artificiel (Tc) et du rhénium.
 La classification subit un premier assaut avec la découverte, en 1894, de 2 gaz simples sur la planète terre : l'argon dans l'air par Lord Rayleigh et W. Ramsay, et l'hélium dans un minerai d'uranium par W. Ramsay (l'hélium avait été identifié dans l'atmosphère solaire en 1868, d'où son nom dérivé de helios, soleil en grec). Comme aucune place dans le tableau périodique n'était prévue pour recevoir ces nouveaux éléments, on trouva un ajustement en y ajoutant une colonne supplémentaire, une heureuse solution qui amena Ramsay à prévoir l'existence de 3 nouveaux gaz, homologues de l'hélium et l'argon pour compléter cette dernière colonne en conformité avec les rangées déjà existantes. Encore une fois, l'expérience confirma les prévisions : Ramsay et M.W. Travers isolèrent, en 1898, le néon, le krypton et le xénon. Le radon s'ajouta bientôt (1900) à cette colonne à laquelle on attribua le numéro zéro, VIII A ou VIII B dans différents formats du tableau périodique. La classification subit un premier assaut avec la découverte, en 1894, de 2 gaz simples sur la planète terre : l'argon dans l'air par Lord Rayleigh et W. Ramsay, et l'hélium dans un minerai d'uranium par W. Ramsay (l'hélium avait été identifié dans l'atmosphère solaire en 1868, d'où son nom dérivé de helios, soleil en grec). Comme aucune place dans le tableau périodique n'était prévue pour recevoir ces nouveaux éléments, on trouva un ajustement en y ajoutant une colonne supplémentaire, une heureuse solution qui amena Ramsay à prévoir l'existence de 3 nouveaux gaz, homologues de l'hélium et l'argon pour compléter cette dernière colonne en conformité avec les rangées déjà existantes. Encore une fois, l'expérience confirma les prévisions : Ramsay et M.W. Travers isolèrent, en 1898, le néon, le krypton et le xénon. Le radon s'ajouta bientôt (1900) à cette colonne à laquelle on attribua le numéro zéro, VIII A ou VIII B dans différents formats du tableau périodique.
La classification eut à subir un autre assaut avec l'identification sur une assez longue durée (1878-1907) d'une dizaine d'éléments chimiquement voisins, semblables à des éléments déjà connus, mais qui avaient été difficiles à classer dans le système de Mendeleïev. On les nomma groupe des «terres rares». Encore une fois, on réussit à sauvegarder l'échafaudage de Mendeleïev en plaçant tout le groupe des «terres rares» dans une seule et même case, celle du lanthane. Ce groupe d'éléments, compris entre le lanthane et l'hafnium, prit éventuellement le nom de série des lanthanides. Il y eut beaucoup de tâtonnements en essayant de les déployer dans un système de classification avant d'en arriver à la forme actuelle qui place le groupe de 14 éléments (Z = 58-71) sous forme d'une rangée horizontale à la base du tableau.
L'étude de la désintégration radioactive de l'uranium, en fait celle des radio-isotopes U-238 et U-235, et du thorium, le Th-232, par Marie et Pierre Curie, Ernest Rutherford, Frederick Soddy et d'autres éminents chercheurs mena à la découverte de 7 éléments manquants, tous radioactifs : le polonium (1898), le radium (1898), l'actinium (1899), le radon (1900), le protactinium (1917), la francium (1939) et l'astate (1940). Ils trouvèrent tout naturellement leur place dans les cases laissées vacantes entre le bismuth et l'uranium. Notons que l'astate, bien que produit en très petites quantités dans les chaînes et désintégration de U-238, U-235 et Th-232 a été d'abord obtenu par l'irradiation du bismuth avec des particules alpha dans un cyclotron selon la réaction
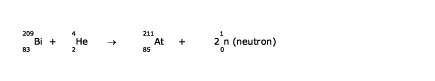
L'ajout, très tôt, dans les bonnes cases de 4 éléments manquants (Po, Ra, Ac, Rn) apportait une preuve additionnelle au bien-fondé de la classification de Mendeleïev qui devint acceptée presque par tous. Toutefois, il existait encore un accroc au principe de cette classification selon lequel les éléments devaient se ranger selon l'ordre croissant de leurs poids atomiques. Cet accroc consistait en des inversions de poids atomiques qu'il fallait introduire pour trois paires d'éléments pour que ces derniers se retrouvent dans le même groupe que leurs homologues. Ces inversions sont : l'argon (39,95) avant le potassium (39,10), le cobalt (58,93) avant le nickel (58,69), et le tellure (127,60) avant l'iode (126,90). Le développement des théories modernes sur la structure de l'atome permit cependant d'expliquer ces inversions.
Au début du XX ième siècle, l'atome commença à livrer ses secrets :
- avec la conception du modèle nucléaire de l'atome par Rutherford et son école (1911-1912);
- avec l'observation par C.G. Barkla (1911) de raies caractéristiques émises par les éléments, raies maintenant appelées rayons X caractéristiques;
- avec la suggestion révolutionnaire par N. Bohr (1913) que les électrons occupent des états stationnaires (pas de pertes d'énergie dans cet état) et qu'ils émettent de l'énergie de façon discontinue, par quanta ou paquets, seulement en passant d'un état à un autre (émission de rayons X caractéristiques);
- avec la proposition de A. van den Broëk (1913) que le nombre de charges positives (les protons) dans le noyau d'un atome coïncide avec le rang de l'élément dans le tableau.
  L'aboutissement fut les travaux de H.G.J. Moseley (1913) qui fit une étude systématique des rayons X caractéristiques émis par un certain nombre d'éléments bien identifiés. Ce physicien anglais trouva que leurs rayons X caractéristiques se différenciaient par un décalage régulier avec l'ordre croissant de leurs rangs ou numéros atomiques selon la nouvelle nomenclature. Moseley tira de ces résultats une relation simple (la loi de Moseley) permettant de déterminer les valeurs exactes des numéros atomiques de n'importe lequel élément par la mesure de leurs rayons X caractéristiques. Ce résultat eut pour conséquence de montrer qu'il était plus naturel de ranger les éléments par ordre croissant des numéros atomiques que par celui des poids atomiques, éliminant ainsi le problème des inversions précitées. La composition isotopique des éléments explique ces inversions dans le classement par ordre de poids atomique. Des travaux de Moseley découla une nouvelle classification des éléments dans laquelle le rang occupé par chaque élément prit le nom de numéro atomique, depuis le numéro 1, attribué à l'hydrogène, jusqu'au numéro 92, attribué à l'uranium. La loi de Moseley devint un outil puissant pour reconnaître le numéro atomique et le rang d'éléments manquants dans le tableau périodique. L'aboutissement fut les travaux de H.G.J. Moseley (1913) qui fit une étude systématique des rayons X caractéristiques émis par un certain nombre d'éléments bien identifiés. Ce physicien anglais trouva que leurs rayons X caractéristiques se différenciaient par un décalage régulier avec l'ordre croissant de leurs rangs ou numéros atomiques selon la nouvelle nomenclature. Moseley tira de ces résultats une relation simple (la loi de Moseley) permettant de déterminer les valeurs exactes des numéros atomiques de n'importe lequel élément par la mesure de leurs rayons X caractéristiques. Ce résultat eut pour conséquence de montrer qu'il était plus naturel de ranger les éléments par ordre croissant des numéros atomiques que par celui des poids atomiques, éliminant ainsi le problème des inversions précitées. La composition isotopique des éléments explique ces inversions dans le classement par ordre de poids atomique. Des travaux de Moseley découla une nouvelle classification des éléments dans laquelle le rang occupé par chaque élément prit le nom de numéro atomique, depuis le numéro 1, attribué à l'hydrogène, jusqu'au numéro 92, attribué à l'uranium. La loi de Moseley devint un outil puissant pour reconnaître le numéro atomique et le rang d'éléments manquants dans le tableau périodique.
Parallèlement aux révélations sur l'atome se développa la notion d'isotopie pour résoudre le problème suivant. La désintégration radioactive de l'uranium et celle du thorium menait à l'identification d'une trentaine d'espèces radioactives qui, en se transmutant, aboutissaient au plomb, un élément stable. Or ces espèces radioactives étaient en nombre bien plus grand que celui des cases vides dans le tableau périodique entre l'uranium et le bismuth. Surtout certaines de ces espèces avaient un comportement chimique identique. Pour résoudre cette énigme, Soddy émit en 1913 l'hypothèse d'atomes chimiquement identiques avec des poids atomiques et des propriétés nucléaires différents pour lesquels il proposa le nom d'isotopes. Cette hypothèse s'est avérée juste. Après avoir montré que le plomb avait aussi des isotopes, on émit la possibilité qu'il devait en être ainsi pour les autres éléments. Il revint à F.W. Aston en Angleterre et à A.J. Dempster aux États-Unis d'examiner à cette fin tous les éléments à l'aide d'un spectrographe de masse et, dès 1921, cette recherche avait montré que tous les éléments, hormis une vingtaine, possèdent des isotopes. Le poids atomique d'un élément que nous appellerons désormais la masse atomique dépend de la masse et de l'abondance des isotopes qui le composent. Il arrive que le jeu de ces deux grandeurs ait produit les inversions des masses atomiques avec l'ordre croissant des numéros atomiques pour les 3 paires d'éléments déviants en plus de celle du thorium (232.04) et du protactinium (231,04).
  En 1922, N. Bohr donna une interprétation du tableau périodique d'après la structure électronique des atomes et par le fait même une explication très simple de la périodicité des éléments : «Les éléments sont chimiquement voisins si les couches extérieures de leurs atomes offrent la même configuration électronique». C'est la base du système périodique des éléments. Par exemple, ce développement suggèrera de rechercher l'élément manquant avec Z = 72 dans les minerais de l'élément chimiquement voisin, le zirconium; ce qui fut fait et on identifia l'hafnium (1923) par l'observation de ses rayons X caractéristiques (application de la loi de Moseley). En 1926, Pauli avec son fameux principe d'exclusion, selon lequel il ne peut exister simultanément dans l'atmosphère électronique d'un atome deux électrons caractérisés par des valeurs identiques des quatre nombres quantiques, compléta l'explication de Bohr. Selon R.P. Feynman, célèbre physicien américain, c'est ce principe qui fait que toute matière ne peut s'écraser sur elle-même, mais qu'elle doit occuper un espace minimal. En 1922, N. Bohr donna une interprétation du tableau périodique d'après la structure électronique des atomes et par le fait même une explication très simple de la périodicité des éléments : «Les éléments sont chimiquement voisins si les couches extérieures de leurs atomes offrent la même configuration électronique». C'est la base du système périodique des éléments. Par exemple, ce développement suggèrera de rechercher l'élément manquant avec Z = 72 dans les minerais de l'élément chimiquement voisin, le zirconium; ce qui fut fait et on identifia l'hafnium (1923) par l'observation de ses rayons X caractéristiques (application de la loi de Moseley). En 1926, Pauli avec son fameux principe d'exclusion, selon lequel il ne peut exister simultanément dans l'atmosphère électronique d'un atome deux électrons caractérisés par des valeurs identiques des quatre nombres quantiques, compléta l'explication de Bohr. Selon R.P. Feynman, célèbre physicien américain, c'est ce principe qui fait que toute matière ne peut s'écraser sur elle-même, mais qu'elle doit occuper un espace minimal.
En 1932, J. Chadwick réussit à identifier la nature de la particule dans le noyau qui cause la différence de masse des isotopes d'un élément. C'est le neutron, une particule sans charge électrique, de masse voisine de celle du proton, facile à produire par des réactions nucléaires et en retour largement utilisée pour la production de radio-isotopes. Ceci nous amène à la définition moderne d'un isotope qui repose sur l'hypothèse que le noyau atomique est composé de Z protons et de N neutrons et qui nous enseigne que les isotopes d'un élément ont la même valeur de Z, mais différentes valeurs de N. Les propriétés chimiques d'un élément dépendent seulement de Z (le numéro atomique) tandis que les propriétés nucléaires dépendent à la fois de Z et de N.
En 1934, la fabrication du phosphore radioactif par les Joliot-Curie en bombardant de l'aluminium avec des particules alpha selon la réaction nucléaire
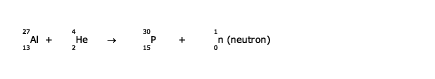
a été la première indication que les éléments stables avaient des isotopes radioactifs. Le 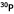 se désintègre par émission bêta en se désintègre par émission bêta en 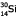 , un isotope stable. C'était la découverte de la radioactivité artificielle. Depuis on a trouvé que chaque élément stable possède plusieurs isotopes radioactifs et on en dénombre de l'ordre de 2500 pour les 81 éléments stables. , un isotope stable. C'était la découverte de la radioactivité artificielle. Depuis on a trouvé que chaque élément stable possède plusieurs isotopes radioactifs et on en dénombre de l'ordre de 2500 pour les 81 éléments stables.
La découverte de la radioactivité artificielle combinée avec l'avènement des accélérateurs de particules à partir de 1930 et des réacteurs nucléaires à partir de 1942 ouvrait de nouvelles portes pour synthétiser de nouveaux éléments et ainsi prolonger le tableau périodique. En fait, à ce jour, ces installations ont servi à synthétiser 23 éléments nouveaux, tous radioactifs, n'existant pas dans la nature, d'où l'appellation de radioéléments artificiels.
 En 1937, l'accélérateur de particules a servi à produire l'élément manquant avec Z = 43, ce qui marquait la découverte du premier radioélément artificiel, appelé technétium. L'accélérateur de particules peut servir à produire tous les radioéléments artificiels. Il est la seule installation, pour le moment, qui permet, à la fois, de produire et d'isoler les radioéléments au-delà du fermium (Z = 100). En 1937, l'accélérateur de particules a servi à produire l'élément manquant avec Z = 43, ce qui marquait la découverte du premier radioélément artificiel, appelé technétium. L'accélérateur de particules peut servir à produire tous les radioéléments artificiels. Il est la seule installation, pour le moment, qui permet, à la fois, de produire et d'isoler les radioéléments au-delà du fermium (Z = 100).
En 1944, les réacteurs nucléaires ont servi à produire un autre élément manquant avec Z = 61, le prométhium, une «terre rare». La capture de neutrons par l'uranium dans les réacteurs nucléaires devint et demeure toujours la méthode privilégiée pour produire plusieurs éléments artificiels. D'une part, la fission de U-235 engendre des centaines d'isotopes (radioactifs et stables avec Z allant de  29 à 29 à  66) dont une quinzaine d'entre eux sont des radio-isotopes du Tc et du Pm. D'autre part, la capture de neutrons par U-238 pour former du U-239 marque le point de départ pour la synthèse de transuraniens allant de Np à Fm. Dans les réacteurs nucléaires, les transuraniens s'accumulent graduellement à la suite de la désintégration bêta des isotopes et la capture de neutrons par les produits de cette désintégration. Puisque l'uranium demeure de l'ordre de un à deux ans dans un réacteur, une quantité imposante de transuraniens s'y amasse. 66) dont une quinzaine d'entre eux sont des radio-isotopes du Tc et du Pm. D'autre part, la capture de neutrons par U-238 pour former du U-239 marque le point de départ pour la synthèse de transuraniens allant de Np à Fm. Dans les réacteurs nucléaires, les transuraniens s'accumulent graduellement à la suite de la désintégration bêta des isotopes et la capture de neutrons par les produits de cette désintégration. Puisque l'uranium demeure de l'ordre de un à deux ans dans un réacteur, une quantité imposante de transuraniens s'y amasse.
La place des transuraniens dans le tableau périodique se résolut tout naturellement eu égard à leurs ressemblances avec les «terres rares» : même configuration électronique sur les couches extérieures, donc chimiquement voisins. Dès 1944, G.T. Seaborg, impliqué dans la découverte de 7 transuraniens, proposa de les apparier avec les lanthanides en formant une nouvelle série, les actinides. Après quelques tâtonnements, on déplaça le Th, le Pa et l'U de leurs positions occupées jusqu'alors pour les ranger dans cette nouvelle série qui devait compter 14 éléments (Z = 90-103). C'est pourquoi, on trouve la série des actinides sous-jacente à celle des lanthanides dans le tableau périodique.
  Dès 1969, un élément au-delà de la série des actinides fut synthétisé. C'était le rutherfordium (Z = 104), et depuis il y en a eu 9 autres (situation en 2002). Seaborg suggéra d'appeler cette nouvelle série, les transactinides. Des calculs avaient montré que la configuration électronique de leurs couches extérieures devrait correspondre à celle des éléments allant de Hf à Rn. L'étude des propriétés chimiques de Rf ont confirmé qu'il était un homologue du Hf, tandis que celle sur le dubnium (Z = 105), l'élément suivant, a montré qu'il partageait à la fois des analogies avec Ta et Pa. Il semble qu'on n'ait pas encore réussi à obtenir des résultats probants sur le comportement chimique des éléments 106 et suivants : les minuscules quantités disponibles et les courtes périodes radioactives des isotopes synthétisés sont les obstacles à vaincre avec ces éléments super lourds pour poursuivre ce genre d'étude. Si la tendance observée avec le dubnium se poursuit, cette série d'éléments pourrait avoir des analogies avec plus d'un groupe d'éléments, un comportement qui s'expliquerait par le fait que les niveaux d'énergie des configurations extérieures, en devenant de plus en plus rapprochés avez Z croissant, donnent naissance à des configurations électroniques atypiques dans différents états d'oxydation. La recherche de nouveaux super lourds, éléments et radio-isotopes, se poursuit activement dans au moins trois centres de recherche à travers le monde de sorte que des découvertes dans ce domaine vont inévitablement se produire à plus ou moins brève échéance. Dès 1969, un élément au-delà de la série des actinides fut synthétisé. C'était le rutherfordium (Z = 104), et depuis il y en a eu 9 autres (situation en 2002). Seaborg suggéra d'appeler cette nouvelle série, les transactinides. Des calculs avaient montré que la configuration électronique de leurs couches extérieures devrait correspondre à celle des éléments allant de Hf à Rn. L'étude des propriétés chimiques de Rf ont confirmé qu'il était un homologue du Hf, tandis que celle sur le dubnium (Z = 105), l'élément suivant, a montré qu'il partageait à la fois des analogies avec Ta et Pa. Il semble qu'on n'ait pas encore réussi à obtenir des résultats probants sur le comportement chimique des éléments 106 et suivants : les minuscules quantités disponibles et les courtes périodes radioactives des isotopes synthétisés sont les obstacles à vaincre avec ces éléments super lourds pour poursuivre ce genre d'étude. Si la tendance observée avec le dubnium se poursuit, cette série d'éléments pourrait avoir des analogies avec plus d'un groupe d'éléments, un comportement qui s'expliquerait par le fait que les niveaux d'énergie des configurations extérieures, en devenant de plus en plus rapprochés avez Z croissant, donnent naissance à des configurations électroniques atypiques dans différents états d'oxydation. La recherche de nouveaux super lourds, éléments et radio-isotopes, se poursuit activement dans au moins trois centres de recherche à travers le monde de sorte que des découvertes dans ce domaine vont inévitablement se produire à plus ou moins brève échéance.
Une forme moderne du tableau des éléments (tableau 5) complète cette présentation. On sait qu'il s'appelle périodique à cause de la répétition des propriétés en fonction du numéro atomique. Ces répétitions se reproduisent assez régulièrement dans chacune des 18 colonnes verticales, ou groupes, disposées sur 7 rangées horizontales ou périodes, chacune ayant respectivement 2, 8, 8, 18, 18, 32 et 27 éléments (la 7e et dernière rangée est incomplète et doit avoir 32 éléments). Les séries des lanthanides et des actinides pourraient trouver leur place dans le corps du tableau aux 6e et 7e rangées respectivement, mais pour des raisons d'espace, elles y sont détachées et placées à la base du tableau. On a vu que l'explication naturelle de cette périodicité se trouve dans le détail de la structure électronique de l'atome telle que décrite par la théorie quantique. Ce fut le génie de Mendeleïev d'avoir trouvé par l'observation des propriétés macroscopiques des éléments, une classification qui a été confirmée cinquante ans plus tard, par l'étude des propriétés microscopiques des atomes. Le tableau périodique est donc issu à la fois de la chimie classique et de la physique quantique. Ce fut aussi le génie de Mendeleïev d'avoir inventé une classification qui a joué un rôle primordial pour prédire le rang d'éléments manquants, pour faire avancer les connaissances sur la nature de l'atome, pour arriver au concept du numéro atomique, pour dégager la notion d'isotopie, pour prédire la configuration électronique des éléments artificiels au-delà de l'uranium et bien sûr d'avoir inventé une classification qui offre une systématique pour interpréter le comportement des éléments par groupes, par périodes, par blocs, et ainsi rendre facile et agréable l'enseignement de la chimie minérale. Pour toutes ces raisons, dans le numéro spécial du New York Times du 18 avril 1999, intitulé «The Best Ideas, Stories and Inventions of the Last Thousand Years», Oliver Sacks (p.116) a jugé que la meilleure invention du millénaire avait été le tableau périodique des éléments chimiques. Qu'on soit d'accord ou pas avec ce jugement d'Oliver Sacks, on s'accordera certainement pour affirmer que le tableau périodique des éléments chimiques suscite et suscitera toujours un immense intérêt parce qu'il constitue un guide précieux pour l'étude de la chimie et des sciences connexes.
Ce dernier tableau périodique a été aménagé pour mettre en évidence quatre caractéristiques des éléments : l'année de leur découverte, le nombre d'isotopes stables associé à 81 éléments, le caractère radioactif naturel ou artificiel des 32 autres. L'année de la découverte reste essentielle pour suivre l'évolution de la classification de Mendeleïev. Les autres caractéristiques relèvent de la configuration du noyau de l'atome plutôt que de sa configuration électronique et ajoutent de l'information sur la nature ou le comportement des éléments. Par exemple, les applications des éléments radioactifs dépendent surtout de leurs propriétés nucléaires. Par exemple, les radioéléments naturels sont beaucoup plus accessibles que les artificiels. Par exemple, le nombre d'isotopes stables sont plus ou moins nombreux selon que Z est pair ou impair pour des raisons nucléaires. Enfin, il est utile de savoir que les éléments avec un seul isotope stable ont les masses atomiques les plus précises parce que l'abondance isotopique, la principale source d'erreur, n'entre pas dans le calcul de cette grandeur pour cette classe d'élément.
Cet exposé se termine par la liste (tableau 6) des masses atomiques relatives des éléments qui sont partagées selon les trois divisions suivantes : éléments stables, éléments radioactifs naturels et éléments radioactifs artificiels.
RÉFÉRENCES:
- Choppin G.R., Liljenzin J.O. et Rydberg J., Radiochemistry and Nuclear Chemistry, 2e édition, Butterworth – Heinemann Ltd., 1995.
- Glasstone S., Source Book on Atomic Energy, 3e édition, D. Van Nostrand Co. Inc., 1967.
- Hey T. et Walters P., The Quantum Universe, Cambridge University Press, 1987.
- Keller O.L. et Seaborg G.T., Ann. Rev. Nuc. Sci., 139-166, 1977.
- Massain R., Chimie et Chimistes, 4e édition, Magnard, 234-247, 1963.
- Pauling L., Chimie Générale, Dunod 100-104, 1960.
- Seaborg G.T., ASM News 11, No. 1, 1980.
- Silva R., Harris J., Nurmia M., Eskola K. et Ghiorso A., Inorganic Nuc. Chem. Lett., 6, No. 12, 871-877, 1970.
- Van Spronsen J.W., The Periodic System of Chemical Elements, A History of the First Hundred Years, Elsevier Publishing Co., 1969.
|
|
|









|
|
|
|
|
|
|









 , et du germanium (1886) fut un triomphe pour la nouvelle classification qui, dès lors, suscita un immense intérêt dans la communauté scientifique. Quatre des six autres prédictions se réalisèrent beaucoup plus tard avec l'identification de 2 radioéléments naturels (Fr et Po), du premier radioélément artificiel (Tc) et du rhénium.
, et du germanium (1886) fut un triomphe pour la nouvelle classification qui, dès lors, suscita un immense intérêt dans la communauté scientifique. Quatre des six autres prédictions se réalisèrent beaucoup plus tard avec l'identification de 2 radioéléments naturels (Fr et Po), du premier radioélément artificiel (Tc) et du rhénium. La classification subit un premier assaut avec la découverte, en 1894, de 2 gaz simples sur la planète terre : l'argon dans l'air par Lord Rayleigh et W. Ramsay, et l'hélium dans un minerai d'uranium par W. Ramsay (l'hélium avait été identifié dans l'atmosphère solaire en 1868, d'où son nom dérivé de helios, soleil en grec). Comme aucune place dans le tableau périodique n'était prévue pour recevoir ces nouveaux éléments, on trouva un ajustement en y ajoutant une colonne supplémentaire, une heureuse solution qui amena Ramsay à prévoir l'existence de 3 nouveaux gaz, homologues de l'hélium et l'argon pour compléter cette dernière colonne en conformité avec les rangées déjà existantes. Encore une fois, l'expérience confirma les prévisions : Ramsay et M.W. Travers isolèrent, en 1898, le néon, le krypton et le xénon. Le radon s'ajouta bientôt (1900) à cette colonne à laquelle on attribua le numéro zéro, VIII A ou VIII B dans différents formats du tableau périodique.
La classification subit un premier assaut avec la découverte, en 1894, de 2 gaz simples sur la planète terre : l'argon dans l'air par Lord Rayleigh et W. Ramsay, et l'hélium dans un minerai d'uranium par W. Ramsay (l'hélium avait été identifié dans l'atmosphère solaire en 1868, d'où son nom dérivé de helios, soleil en grec). Comme aucune place dans le tableau périodique n'était prévue pour recevoir ces nouveaux éléments, on trouva un ajustement en y ajoutant une colonne supplémentaire, une heureuse solution qui amena Ramsay à prévoir l'existence de 3 nouveaux gaz, homologues de l'hélium et l'argon pour compléter cette dernière colonne en conformité avec les rangées déjà existantes. Encore une fois, l'expérience confirma les prévisions : Ramsay et M.W. Travers isolèrent, en 1898, le néon, le krypton et le xénon. Le radon s'ajouta bientôt (1900) à cette colonne à laquelle on attribua le numéro zéro, VIII A ou VIII B dans différents formats du tableau périodique.




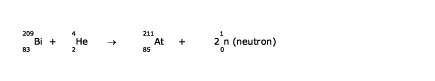

 L'aboutissement fut les travaux de H.G.J. Moseley (1913) qui fit une étude systématique des rayons X caractéristiques émis par un certain nombre d'éléments bien identifiés. Ce physicien anglais trouva que leurs rayons X caractéristiques se différenciaient par un décalage régulier avec l'ordre croissant de leurs rangs ou numéros atomiques selon la nouvelle nomenclature. Moseley tira de ces résultats une relation simple (la loi de Moseley) permettant de déterminer les valeurs exactes des numéros atomiques de n'importe lequel élément par la mesure de leurs rayons X caractéristiques. Ce résultat eut pour conséquence de montrer qu'il était plus naturel de ranger les éléments par ordre croissant des numéros atomiques que par celui des poids atomiques, éliminant ainsi le problème des inversions précitées. La composition isotopique des éléments explique ces inversions dans le classement par ordre de poids atomique. Des travaux de Moseley découla une nouvelle classification des éléments dans laquelle le rang occupé par chaque élément prit le nom de numéro atomique, depuis le numéro 1, attribué à l'hydrogène, jusqu'au numéro 92, attribué à l'uranium. La loi de Moseley devint un outil puissant pour reconnaître le numéro atomique et le rang d'éléments manquants dans le tableau périodique.
L'aboutissement fut les travaux de H.G.J. Moseley (1913) qui fit une étude systématique des rayons X caractéristiques émis par un certain nombre d'éléments bien identifiés. Ce physicien anglais trouva que leurs rayons X caractéristiques se différenciaient par un décalage régulier avec l'ordre croissant de leurs rangs ou numéros atomiques selon la nouvelle nomenclature. Moseley tira de ces résultats une relation simple (la loi de Moseley) permettant de déterminer les valeurs exactes des numéros atomiques de n'importe lequel élément par la mesure de leurs rayons X caractéristiques. Ce résultat eut pour conséquence de montrer qu'il était plus naturel de ranger les éléments par ordre croissant des numéros atomiques que par celui des poids atomiques, éliminant ainsi le problème des inversions précitées. La composition isotopique des éléments explique ces inversions dans le classement par ordre de poids atomique. Des travaux de Moseley découla une nouvelle classification des éléments dans laquelle le rang occupé par chaque élément prit le nom de numéro atomique, depuis le numéro 1, attribué à l'hydrogène, jusqu'au numéro 92, attribué à l'uranium. La loi de Moseley devint un outil puissant pour reconnaître le numéro atomique et le rang d'éléments manquants dans le tableau périodique.
 En 1922, N. Bohr donna une interprétation du tableau périodique d'après la structure électronique des atomes et par le fait même une explication très simple de la périodicité des éléments : «Les éléments sont chimiquement voisins si les couches extérieures de leurs atomes offrent la même configuration électronique». C'est la base du système périodique des éléments. Par exemple, ce développement suggèrera de rechercher l'élément manquant avec Z = 72 dans les minerais de l'élément chimiquement voisin, le zirconium; ce qui fut fait et on identifia l'hafnium (1923) par l'observation de ses rayons X caractéristiques (application de la loi de Moseley). En 1926, Pauli avec son fameux principe d'exclusion, selon lequel il ne peut exister simultanément dans l'atmosphère électronique d'un atome deux électrons caractérisés par des valeurs identiques des quatre nombres quantiques, compléta l'explication de Bohr. Selon R.P. Feynman, célèbre physicien américain, c'est ce principe qui fait que toute matière ne peut s'écraser sur elle-même, mais qu'elle doit occuper un espace minimal.
En 1922, N. Bohr donna une interprétation du tableau périodique d'après la structure électronique des atomes et par le fait même une explication très simple de la périodicité des éléments : «Les éléments sont chimiquement voisins si les couches extérieures de leurs atomes offrent la même configuration électronique». C'est la base du système périodique des éléments. Par exemple, ce développement suggèrera de rechercher l'élément manquant avec Z = 72 dans les minerais de l'élément chimiquement voisin, le zirconium; ce qui fut fait et on identifia l'hafnium (1923) par l'observation de ses rayons X caractéristiques (application de la loi de Moseley). En 1926, Pauli avec son fameux principe d'exclusion, selon lequel il ne peut exister simultanément dans l'atmosphère électronique d'un atome deux électrons caractérisés par des valeurs identiques des quatre nombres quantiques, compléta l'explication de Bohr. Selon R.P. Feynman, célèbre physicien américain, c'est ce principe qui fait que toute matière ne peut s'écraser sur elle-même, mais qu'elle doit occuper un espace minimal.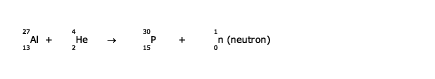
 En 1937, l'accélérateur de particules a servi à produire l'élément manquant avec Z = 43, ce qui marquait la découverte du premier radioélément artificiel, appelé technétium. L'accélérateur de particules peut servir à produire tous les radioéléments artificiels. Il est la seule installation, pour le moment, qui permet, à la fois, de produire et d'isoler les radioéléments au-delà du fermium (Z = 100).
En 1937, l'accélérateur de particules a servi à produire l'élément manquant avec Z = 43, ce qui marquait la découverte du premier radioélément artificiel, appelé technétium. L'accélérateur de particules peut servir à produire tous les radioéléments artificiels. Il est la seule installation, pour le moment, qui permet, à la fois, de produire et d'isoler les radioéléments au-delà du fermium (Z = 100).
 Dès 1969, un élément au-delà de la série des actinides fut synthétisé. C'était le rutherfordium (Z = 104), et depuis il y en a eu 9 autres (situation en 2002). Seaborg suggéra d'appeler cette nouvelle série, les transactinides. Des calculs avaient montré que la configuration électronique de leurs couches extérieures devrait correspondre à celle des éléments allant de Hf à Rn. L'étude des propriétés chimiques de Rf ont confirmé qu'il était un homologue du Hf, tandis que celle sur le dubnium (Z = 105), l'élément suivant, a montré qu'il partageait à la fois des analogies avec Ta et Pa. Il semble qu'on n'ait pas encore réussi à obtenir des résultats probants sur le comportement chimique des éléments 106 et suivants : les minuscules quantités disponibles et les courtes périodes radioactives des isotopes synthétisés sont les obstacles à vaincre avec ces éléments super lourds pour poursuivre ce genre d'étude. Si la tendance observée avec le dubnium se poursuit, cette série d'éléments pourrait avoir des analogies avec plus d'un groupe d'éléments, un comportement qui s'expliquerait par le fait que les niveaux d'énergie des configurations extérieures, en devenant de plus en plus rapprochés avez Z croissant, donnent naissance à des configurations électroniques atypiques dans différents états d'oxydation. La recherche de nouveaux super lourds, éléments et radio-isotopes, se poursuit activement dans au moins trois centres de recherche à travers le monde de sorte que des découvertes dans ce domaine vont inévitablement se produire à plus ou moins brève échéance.
Dès 1969, un élément au-delà de la série des actinides fut synthétisé. C'était le rutherfordium (Z = 104), et depuis il y en a eu 9 autres (situation en 2002). Seaborg suggéra d'appeler cette nouvelle série, les transactinides. Des calculs avaient montré que la configuration électronique de leurs couches extérieures devrait correspondre à celle des éléments allant de Hf à Rn. L'étude des propriétés chimiques de Rf ont confirmé qu'il était un homologue du Hf, tandis que celle sur le dubnium (Z = 105), l'élément suivant, a montré qu'il partageait à la fois des analogies avec Ta et Pa. Il semble qu'on n'ait pas encore réussi à obtenir des résultats probants sur le comportement chimique des éléments 106 et suivants : les minuscules quantités disponibles et les courtes périodes radioactives des isotopes synthétisés sont les obstacles à vaincre avec ces éléments super lourds pour poursuivre ce genre d'étude. Si la tendance observée avec le dubnium se poursuit, cette série d'éléments pourrait avoir des analogies avec plus d'un groupe d'éléments, un comportement qui s'expliquerait par le fait que les niveaux d'énergie des configurations extérieures, en devenant de plus en plus rapprochés avez Z croissant, donnent naissance à des configurations électroniques atypiques dans différents états d'oxydation. La recherche de nouveaux super lourds, éléments et radio-isotopes, se poursuit activement dans au moins trois centres de recherche à travers le monde de sorte que des découvertes dans ce domaine vont inévitablement se produire à plus ou moins brève échéance.