
Polarisabilité
Volume de polarisabilité α/4πεo (en Å3) pour les éléments des 4 premières périodes
H
0.667 |
|
He
0.205 |
Li
24.3 |
Be
5.60 |
|
B
3.03 |
C
1.76 |
N
1.10 |
O
0.802 |
F
0.557 |
Ne
0.396 |
Na
24.1 |
Mg
10.6 |
|
Al
6.8 |
Si
5.38 |
P
3.63 |
S
2.90 |
Cl
2.18 |
Ar
1.64 |
K
43.4 |
Ca
22.8 |
Sc
17.8 |
Ti
14.6 |
V
12.4 |
Cr
11.6 |
Mn
9.4 |
Fe
8.4 |
Co
7.5 |
Ni
6.8 |
Cu
6.2 |
Zn
5.75 |
Ga
8.12 |
Ge
6.07 |
As
4.31 |
Se
3.77 |
Br
3.05 |
Kr
2.48 |
Illustrations
i.1
On observe que la polarisabilité augmente en descendant dans une même famille. Pourquoi?
i.2
On observe que la polarisabilité diminue le long d'une période (de gauche à droite). Pourquoi?
Volume de polarisabilité de quelques molécules et ions
| | α/4πεo (Å3) |
| H2 | 0.804 |
| N2 | 1.740 |
| O2 | 1.581 |
| F2 | 1.38 |
| | α/4πεo (Å3) |
| H2O | 1.45 |
| CO2 | 2.911 |
| CS2 | 8.74 |
| | α/4πεo (Å3) |
| CH4 | 2.593 |
| CF4 | 3.838 |
| CCl4 | 10.5 |
| propène C3H6 | 6.26 |
| cyclopropane C3H6 | 5.66 |
Illustrations
i.3
Expliquez les tendances observées dans le tableau de gauche ci-dessus.
i.4
He et H2 possède le nombre nombre total de protons et d'électrons. Comment expliquer leur différence de polarisabilité?
i.5
Le propène et le cyclopropane sont deux isomères mais leur polarisabilité est différente. Pourquoi?
Effet de la charge du noyau sur le volume de polarisabilité
| | charge
du noyau | nombre
d'électrons | α/4πεo (Å3) |
| H¯ | +1 | 2 | 13.8 |
| He | +2 | 2 | 0.205 |
| Li+ | +3 | 2 | 0.0286 |
| | charge
du noyau | nombre
d'électrons | α/4πεo (Å3) |
| F¯ | +9 | 10 | 0.759 |
| Ne | +10 | 10 | 0.396 |
| Na+ | +11 | 10 | 0.255 |
Exemple de molécule possédant une très grande polarisabilité
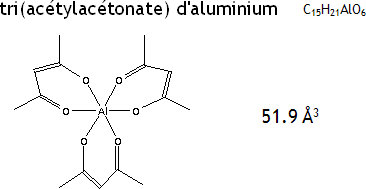
Illustration
i.5
Classer les espèces suivantes en ordre de polarisabilité:
- Césium, Platine, Or
- HCl, HF, HBr, HI
- Cl2, F2, Br2, I2
- K+, Cl¯
- He, Be2+


